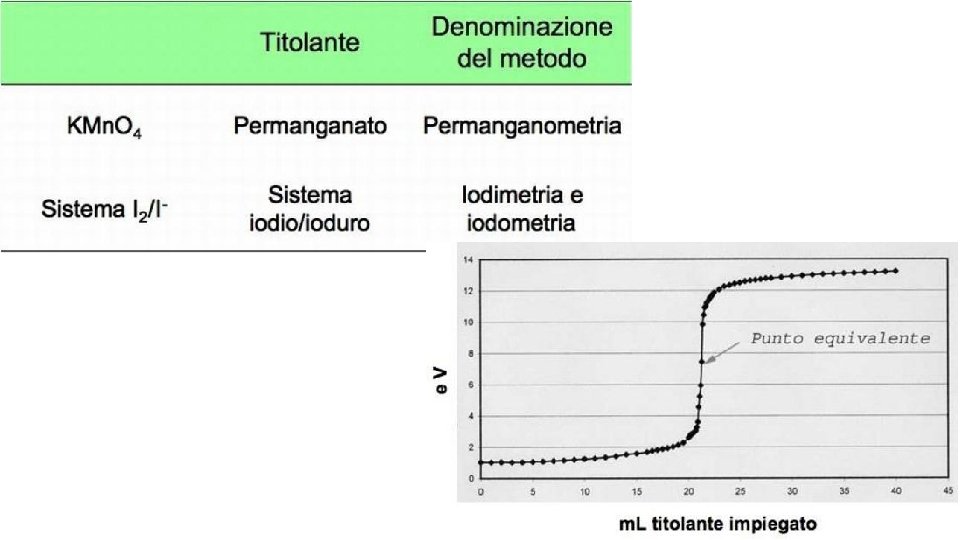
Grafico Titolazione Acido Debole Base Forte oqudina
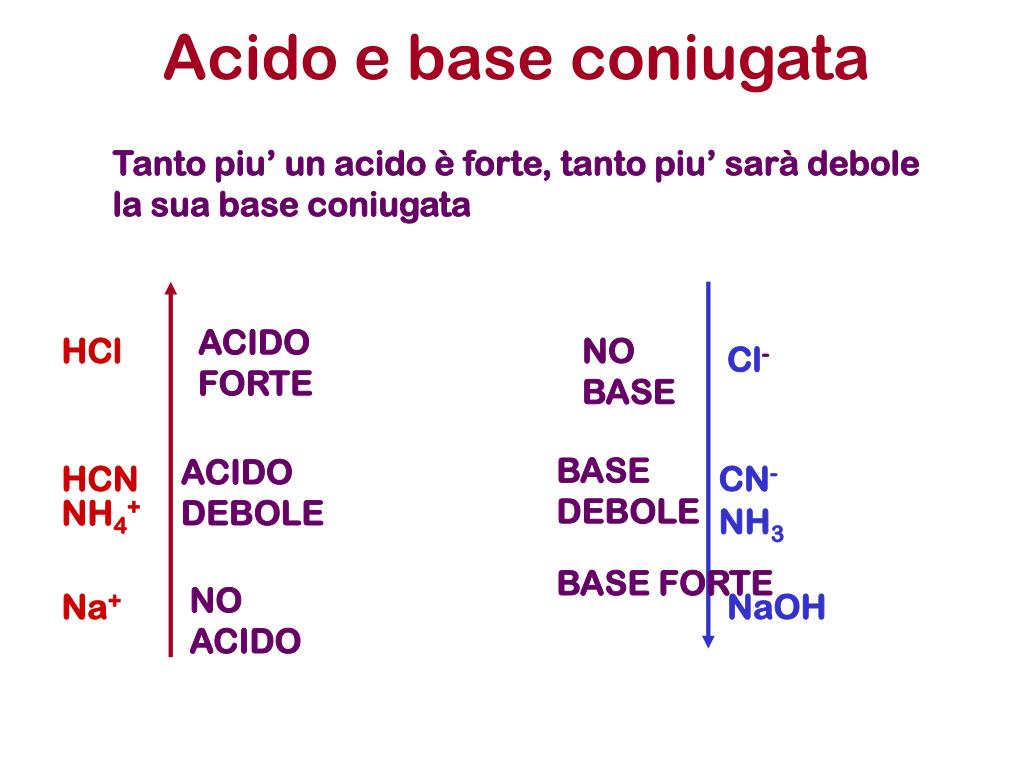
Tabella con i valori della K a e della K b dei principali acidi e basi. Per un generico acido HA che si dissocia in acqua secondo il seguente equilibrio: l’espressione della costante acida (k a) è la seguente: Tanto più questo valore è piccolo tanto meno forte è l’acido considerato. Il valore della costante acida è pertanto una misura di.. Acidi e basi: forti e deboli Sappiamo che gli acidi hanno una caratteristica che li accomuna (in soluzione acquosa forniscono ioni H+), ma hanno anche una proprietà che li differenzia, cioè la «forza». Essa misura la capacità della molecola dell’acido di liberare più o

PPT curva di titolazione base deboleacido forte PowerPoint Presentation ID4898016
Curva di titolazione acido debole base forte Nel

Condicionador Ácido Fluorídrico 5 3mL IndusbelloDentística e Estética Químicos
Ácido Fluorídrico Condac Porcelana 5 2,5ml Fgm A Interdental lhe deseja um dia feliz

Ácido Fluorídrico 20 Trópico Futuro

Hcl Acido Forte O Debole princeselsa
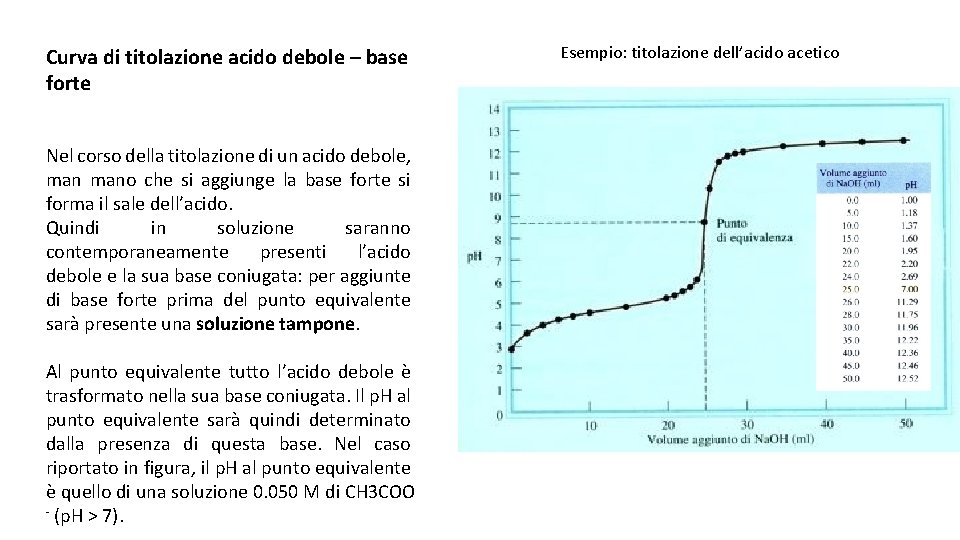
Curva di titolazione acido debole base forte Nel
ÁCIDO FLUORÍDRICO 20 SERINGA BNH

Por que o ÁCIDO FLUORÍDRICO é um ácido fraco? YouTube
Portal do Médico Condicionador Ácido Fluoridrico Acid F Porcelana 5 2i

ACIDO FLUORHIDRICO 40 P.A. x 1000 ml BIOPACK MARBE S.A.
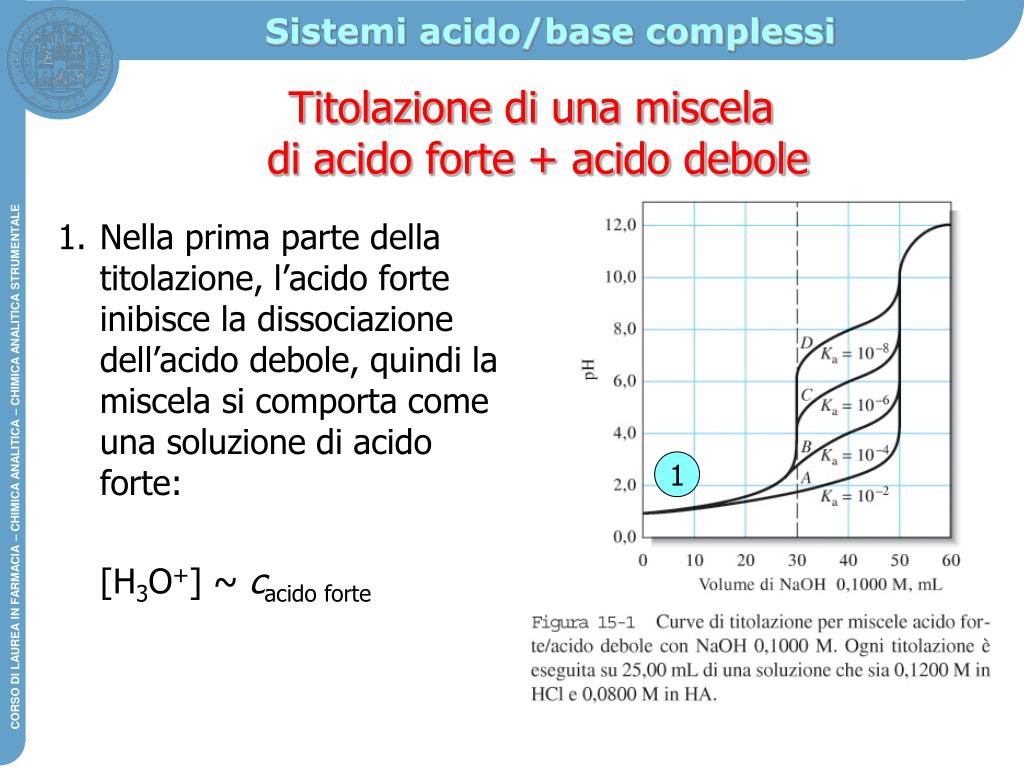
Grafico Titolazione Acido Debole Base Forte oqudina

Diluendo soluzioni di un acido forte o debole

Diluendo soluzioni di un acido forte o debole

Curve di titolazione acido forte/base forte e acido debole/base forte a confronto YouTube

Diluendo soluzioni di un acido forte o debole

Diluendo soluzioni di un acido forte o debole
Hcl Acido Forte O Debole princeselsa

Neutralizzazione di un acido debole con una base forte YouTube

ÁCIDO FLUORÍDRICO CUIDADO
Ma nulla in confronto il fluoroantimonico. Unendo l’ acido fluoridrico (HF) con il pentafluoruro di antimonio (SbF5), si ottiene un risultato notevole: l’acido fluoroantimonico, conosciuto anche.. L’acido fluoridrico o HF è un acido estremamente corrosivo . Tuttavia, è un acido debole e non un acido forte perché non si dissocia completamente in acqua (che è la definizione di acido forte ) o almeno perché gli ioni che forma durante la dissociazione sono troppo fortemente legati l’uno all’altro perché possa agire come un acido forte.


